Atraktivne a bezpečné chemické pokusy prepojené s RUP
Chemiluminiscencia
Chemiluminiscencia je jav, kedy dochádza v dôsledku chemickej reakcie k emisii studeného svetla. Behom chemiluminiscenčnej reakcie vzniká z reaktantov reakčný intermediát, ktorý sa nachádza v energeticky bohatom, excitovanom stave. Následný prechod tejto excitovanej molekuly do základného stavu je sprevádzaný vyžiarením kvanta svetelnej energie. Detailnejšie je tento scenár vyobrazený na následujúcej Schéme 1.

Látka A a B spolu spolu reagujú za vzniku produktov C* a D, z čoho produkt C sa nachádza v excitovanom alebo inak energeticky bohatom stave. Produkt alebo prechodný intermediát C* sa svojej nadbytočnej energie môže zbaviť viacerými pochodmi:
- neproduktívne nežiarivé prechody za vzniku tepla (nežiadúci proces)
- priama deexcitácia C* žiarivým prechodom za emisie svetla charakteristickej pre C*
- nepriama deexcitácia C* žiarivým prechodom – C* svoju prebytočnú energiu predá vhodnej molekule floresceru, ktorá ju dokáža prijať a následne vyžiariť. Emisné spektrum je potom závislé na štruktúre fluoresceru.

Ako už bolo v úvode spomenuté, najznámejším a prvým zdokumentovaným príkladom človekom vyvolanej chemiluminiscencie bol objav elementárneho fosforu hamburským alchymistom H. Brandom. Zeleno svietiaci voskovitý biely fosfor sa pri izbovej teplote pomaly oxiduje na svojom povchu, pričom vznikajú v plynnej fázi excitované medziprodukty (PO)2 a HPO, ktoré sú zodpovedné za zelenú žiaru.
Tak trochu nešťastne je pojem fosforescencia spojovaný s oxidáciou fosforu, hoci fosforescencia je fenomén čisto fyzikálneho pôvodu, ako bolo vysvetlé už skôr.
Dnešná chémia pozná celý rad príkladov chemických reakcií, ktoré poskytujú chemiluminiscenciu. Patria sem oxidácie luminolu peroxidom vodíka, oxidácia siloxénov, redukcia RuIII komplexov tetrahydridoboritanovým aniónom, oxidácia lofínu, lucigenínu, oxidácia pyrogalolu peroxidom vodíka v prítomnosti formaldehydu, chemiluminiscencia singletového kyslíka, ale asi najväčšieho komerčného rozšírenia doznali aktivované fenolické estery kyseliny šťaveľovej najviac preskúmané americkým výskumníkom M. Rauhutem v šesťdesiatych rokoch dvadsiateho storočia. Chemiluminiscenčné reakcie týchto esterov sú využívané v komerčných svietiacich lámacích tyčinkách.
Úspech reakcie esterov kyseliny šťaveľovej s peroxidom vodíka spočíva vo vysokej účinnosti, pomerne nízkej cene (v porovnaní s ostatnými systémami) a možnosti vhodnou voľbou pridaného fluoresceru zvoliť praktický akúkoľvek farbu, od modrej až po infračervenú. Bolo odmerané, že až 23% chemickej energie týchto systémov sa premieňa na svetlo, čo je najviac zo všetkých neenzymatických systémov.
V literatúre najznámejšie príklady fenolických esterov kyseliny šťaveľovej zahŕňajú estery nazývané DNPO (bis-(2,4-dinitrofenyl)oxalát) a TCPO (bis-(2,4,6-trichlórfenyl)oxalát). Tieto estery sa bežne využívajú v analytickej chémii; ich použitie pre demonštráciu v školách je však nevhodné, pretože ich rozkladom vznikajú silne jedovaté (2,4-dinitrofenol), poprípade nepríjemne zapáchajúce fenoly (2,4,6-trichlorofenol). V tejto súprave je dodaná netoxická, príjemne voňajúca – bis-vanillyl oxalát (BVO), ester kyseliny šťaveľovej a vanilínu, ktorý má podobné chemické správanie, ale postráda tieto nevýhody.
Všeobecne prijímaný mechanizmus tejto chemickej reakcie je popísaný v Schéme 2:
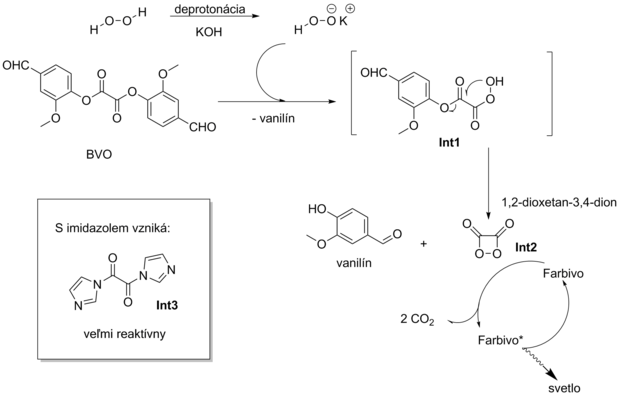
Peroxid vodíka je bázou deprotonovaný na hydroperoxidový anión. Tento vyniká vyššou reaktivitou než samotný peroxid vodíka. Následne tento hydroperoxidový anión reaguje s BVO, v prvom kroku nastáva odštiepenie 1 molekuly vanillínu a vzniku napolyzreagovaného intermediátu Int1, ktorý intramolekulárnou cyklizáciou odštepuje ďalšiu molekulu vanillínu a vzniká napätý štvorčlenný cyklus 1,2-dioxetan-3,4-dion (intermediát Int2). Táto látka je veľmi nestabilná, vysoko energeticky bohatá a svoju energiu predáva molekule farbiva, ktorá potom vstupuje do excitovaného stavu a pritom sa tento štvorčlenný cyklus rozpadá na dve molekuly CO2. Farbivo v excitovanom stave deexcituje vyžiarením fotónu.
Okrem báze ako je napr. KOH (prípadne octan sodný, octan draselný apod.) katalyzujú reakciu aj nukleofilné katalyzátory ako je napr. imidazol. Katalytický efekt imidazolu je daný jeho schopnosťou premieňať BVO na omnoho reaktívnejší bis-imidazolyl oxalát (intermediát Int3), ktorý reaguje s peroxidom vodíku rádovo rýchlejšie.
Peroxyoxalátová chemiluminiscenčná reakcia poskytuje mnoho možností pre pedagogické využitie. S pomocou tejto reakcie sa dá demonštrovať celý rad chemických zákonitostí, ako sú napr. medzifázové transportné javy, závislosť reakčnej rýchlosti na miešaní, teplote, prídavku katalyzátora a pod.
Všeobecne platí, že meranie aj tých najmenších množstiev svetla je extrémne citlivé, preto je možno pomocou chemiluminiscenčných reakcií merať aj stopové množstvá chemických látok. Chemiluminiscenčné reakcie sa využívajú v praxi najmä pre analytické účely. V kriminalistike je známe využitie reakcie luminolu s peroxidom vodíka, ktorá je katalyzovaná stopovým množstvom železa. Keďže sa železo nachádza v krvi, je možné zmesou luminolu a peroxidu vodíka detekovať aj tie najslabšie škvrny po krvi.
Okrem možnosti merať veľmi malé nízke koncentrácie peroxidu vodíka peroxyoxalátovou chemiluminiscenciou je známe veľké množstvo iných reakcií využívaných v analytickej chémii. Jeden taký príklad je stanovenie obsahu oxidu dusnatého vo vzduchu reakciou s ozónom. Presné a rýchle stanovenie oxidu dusnatého je dôležité pri monitorovaní stavu ovzdušia.






